Problemas de disoluciones
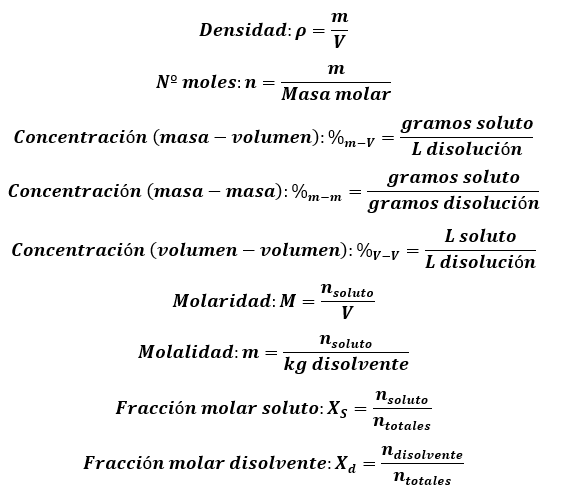
Para realizar problemas de disoluciones definiremos unos cuantos conceptos:
Densidad: masa contenida en un volumen.
Nº de moles: cociente entre la masa del compuesto y su masa molar.
Concentración (masa-volumen): cantidad de soluto (en gramos) en 1 litro de disolución.
Concentración (masa-masa): cociente entre cantidad de soluto (en gramos) y la masa de disolución.
Concentración (volumen-volumen): cociente entre volumen de soluto (en gramos) y el volumen de disolución.
Molaridad (M): cantidad de soluto (en moles) en 1 litro de disolución. Se expresa en ''molar'' y se representa con una ''M''.
Molalidad (m): número de moles de soluto presentes en 1 kg de disolvente. Se expresa en ''molal'' y se representa con una ''m''.
Fracción molar soluto (disolvente): cociente entre el número de moles del soluto (disolvente) y el números de moles totales. La suma de las fracciones molares de soluto y disolvente es siempre 1.
EJEMPLO 1: Se echan 100 gramos de sal a 2 litros de agua. Calcular:
a) Los moles de agua y de sal.
b) La concentración del soluto (en m-m).
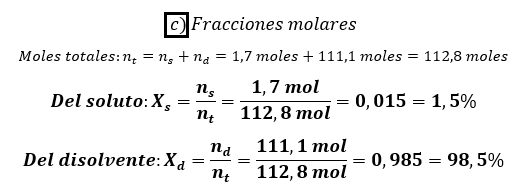
c) La fracción molar del soluto y el disolvente.
d) La molaridad y molalidad.
Masas molares: Oxígeno: 16 g/mol; Hidrógeno: 1 g/mol; Cloro: 35,5 g/mol; Sodio: 23 g/mol




Test de autoevaluación

Test de autoevaluación
* Para tomar nuevamente la autoevaluación presione el botón 'F5'
Test de autoevaluación resuelto:
